·
美国FDA器械主文件的英文为Master Files for Devices (MAFs),与药物主文件(Drug Master Files)类似,任何用于支持器械的PMA, IDE或其他申请的信息都可以通过主文件的形式单独提交到FDA CDRH,用以保护第三方的技术机密或者简化申报的流程。
1)MAFs的分类
MAFs没有具体的分类,其类型可以是如下信息:
- 设施和制造程序及控制;
- 化学品、物料(如合金、塑料等)或器械组件的合成、配制、纯化和标准;
- 包装材料;
- 合同包装和其他制造(如灭菌);
- 非临床研究数据;以及
- 临床研究数据。
2)MAFs的内容
MAFs涉及的信息类型广泛,没有统一的内容要求,但是具体的MAF可以参考相关的指南要求,如化学品或者包材就可以参考药品的相关指南。
MAF中必须要提交说明函,必须用英语书写,如果提交的材料不是实质性的,并且不包含可能被合理视为机密的信息,则不会被视为MAF。
3)MAFs的格式
MAFs需要以eCopy( An electronic copy)的格式提交至FDA CDRH,可以通过esubmitter将MAF的内容文件转换成eCopy的格式。
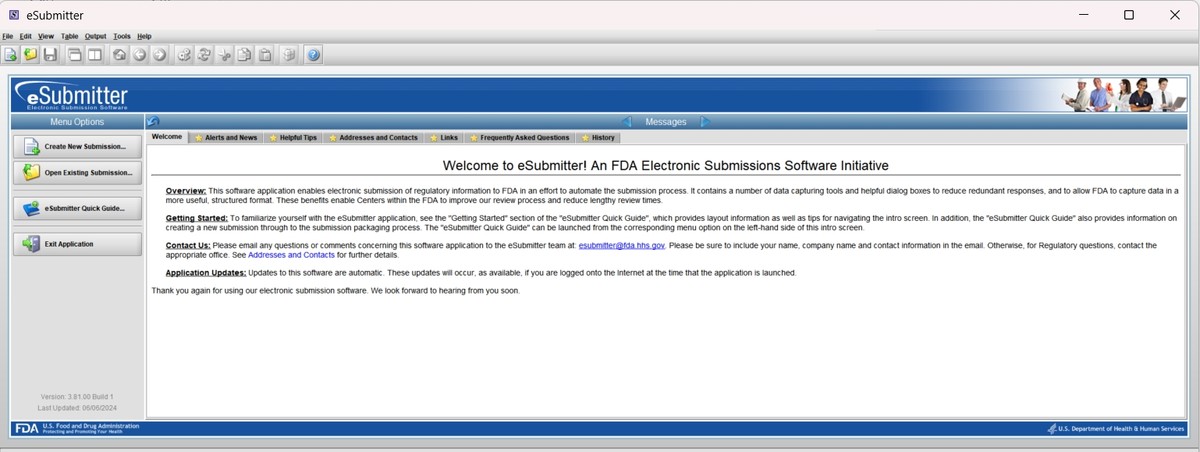
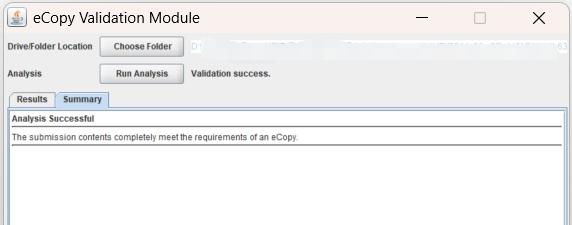
4)eCopy的验证
制作完成的MAF需要进行验证,确保格式符合要求。
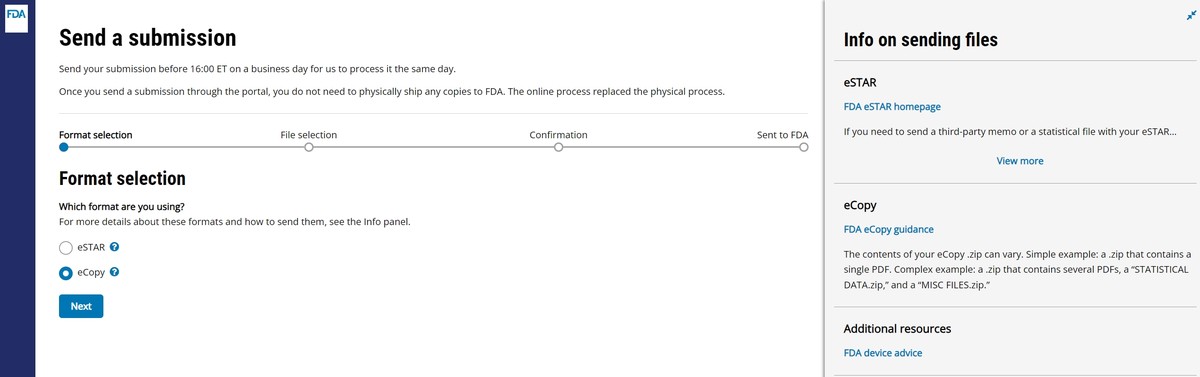
5)MAFs的提交
通过FDA提供的在线系统CDRH Portal提交eCopy。
6)提交确认
提交MAFs后,CDRH会邮件联系MAF持有人,并发送确认信,确认信中包含:MAF号,提交日期,申请人和产品名称等信息。收到此确认信代表MAF提交成功。
