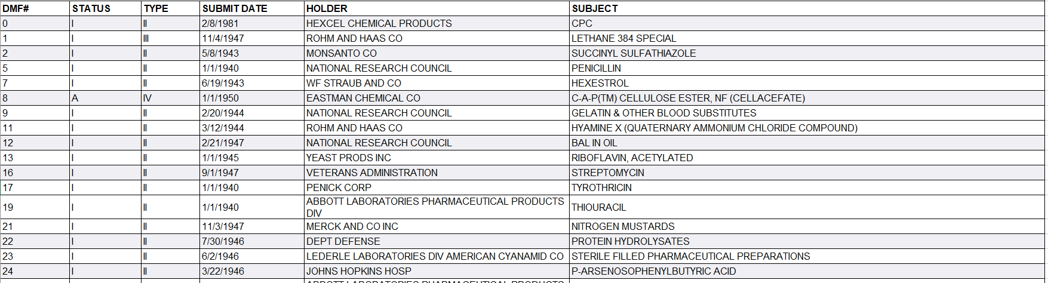
1.什么是DMF
药物主文件,即Drug Master File (DMF),是提交美国FDA的存档待审资料,属于备案。资料内容包括制造、加工、包装、储存、批发人用药品活动中所使用的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。
2. DMF的特性
保密性:DMF持有者向FDA呈交DMF主要目的是支持用户向FDA提交的各种药品申请,而同时又不愿将其化学和生产流程的保密资料抄报用户。
简化性:DMF的另一特点是在FDA中心档案室存档的DMF可以支持所有使用该产品的用户,DMF持有者无须向每一用户重复提供资料。
另外,法律或FDA法规不强制要求提交DMF,DMF完全由持有人自行决定提交。
3. DMF的分类
II型: 原料药、原料药中间体或制剂;
III型: 包装材料;
IV型: 赋形剂、着色剂、香料、香精及其原料;
V型: 可被FDA接受的参考资料。
4. DMF的两种状态
“A”=active:激活状态,意味着DMF可用,没有关闭;
“I”=Inactive:未激活状态,意味着DMF被DMF持有者或FDA关闭。
5.DMF的格式要求
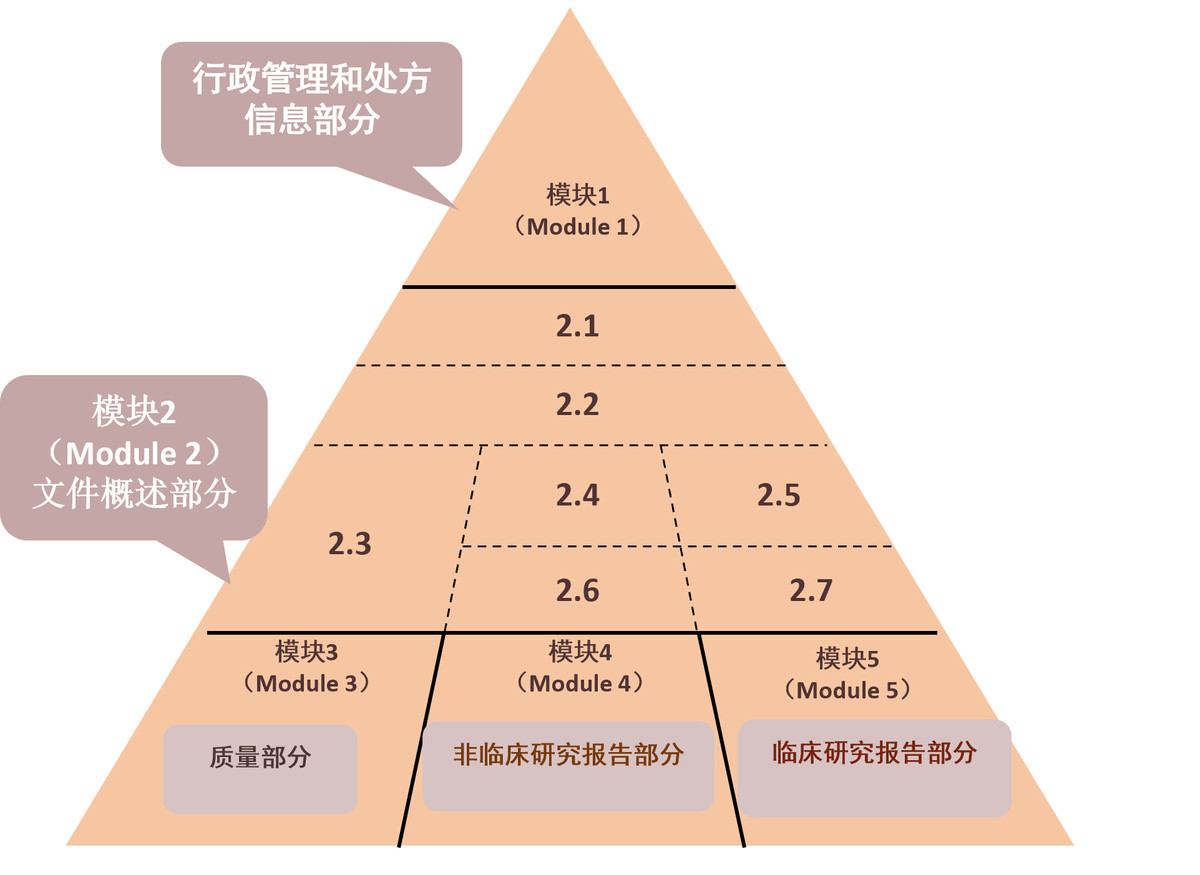
II,III,IV型:CTD国际通用格式;
其他:不做强制要求,参考美国FDA推荐目录;
2015年开始,强制要求eCTD。
6.DMF的审核
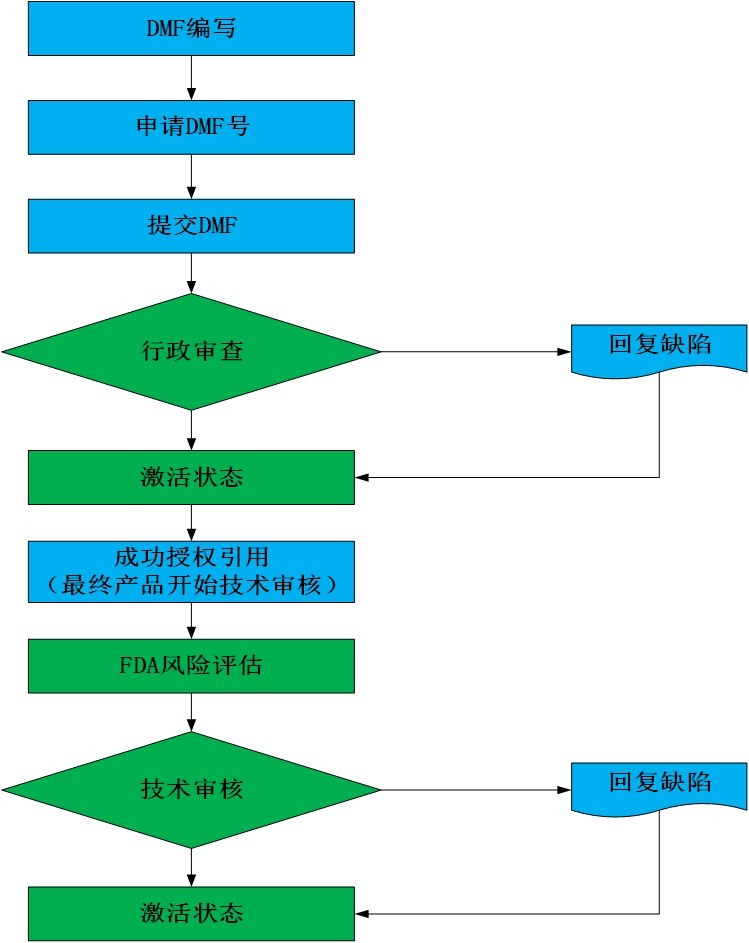
7. DMF的维护
DMF的年报:DMF激活后,需要每年提交年报,没有任何变更也需要提交年报;原则上年报中不能提交新的变更,但是小的变更,如稳定性数据、行政信息的更新,可以同年报一起提交。
DMF增补:DMF增补包括行政增补及质量增补;DMF的任何变更以及信息的增加或者删减,包括LOA,都必须以DMF增补递交给FDA;DMF增补应包含cover letter, 相关升版的行政和技术信息(若适用);DMF持有人必须将DMF的任何变更、信息的增加和删减通知受影响的授权人(一般为制剂方),并应提供足够的信息以便授权人能够为其申请确定适当的变更报告程序。此通知应在进行任何变更之前进行,以允许授权人在适当的时间范围内报告变更。
FDA关闭:自DMF首次递交之日起,3年内未递交年报,FDA向DMF holder发送Overdue Notification Letters,若90个工作日之后仍未递交年报,则关闭DMF;
